O que são Ligações Químicas – Distribuição Eletrônica
Os átomos podem interagir entre si através de ligações químicas. E para entender o que é ligação química temos que entender também o que é camada de valência de um átomo e como é feita a distribuição eletrônica. Ao final desse artigo você vai estar craque nesse assunto.
Já vimos que existem mais de cem elementos químicos na natureza. Sabemos, porém, que a quantidade de diferentes substâncias que poderíamos listar facilmente ultrapassa a quantidade de muitas centenas. Então, como explicar a abundância de substâncias e o relativamente pequeno número de átomos?
A explicação está no fato de que esses átomos dificilmente ocorrem sozinhos: a maioria se une a outros para formar compostos diversos.
Ligações químicas
Entende-se por ligações químicas a união entre átomos. Mas será que todos os átomos são capazes de se ligar a outros?
Para que uma ligação química aconteça, são necessárias certas condições. Alguns átomos são muito reativos e dificilmente são encontrados sozinhos. Outros, no entanto, são muito estáveis e em condições normais não reagem.
Os átomos que não formam compostos são dos elementos conhecidos como gases raros ou nobres. Observe abaixo a distribuição eletrônica em camadas desses átomos.
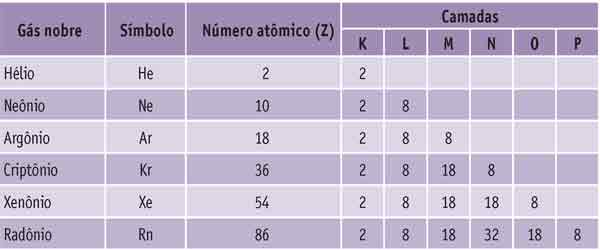
O que há em comum entre eles?
A última camada, em todos, possui oito elétrons. Guarde esse número: ele é fundamental para a compreensão da maioria das ligações químicas.
Mas, e o hélio? Ele não tem oito elétrons em sua camada mais externa.
Isso acontece porque a camada K fica completa com dois elétrons. Portanto, no hélio a camada mais externa (K) está completa.
O número na última segue à regra do octeto Essa regra pressupõe que os átomos fazem ligações químicas para entrar em estabilidade semelhante à de um gás nobre. E para adquirir essa estabilidade é necessário que o átomo tenha sempre 8 elétrons em sua última camada. A exceção a essa regra é o hélio
Para tanto, devem sofrer modificações em sua eletrosfera, para que fiquem com oito elétrons na última camada, como a maioria dos gases nobres.
Essa modificação se dá por meio da perda, do ganho ou do compartilhamento de elétrons. Portanto, para verificar a capacidade de ligação dos átomos, devemos sempre observar sua camada mais externa de elétrons, denominada camada de valência.
Observação: existem exceções à regra do octeto, mas, para nós, ela valerá como orientação geral.
Para entender melhor a camada de valência, observe na tabela periódica a distribuição dos elétrons de alguns átomos. Representamos alguns átomos nos esquemas abaixo.
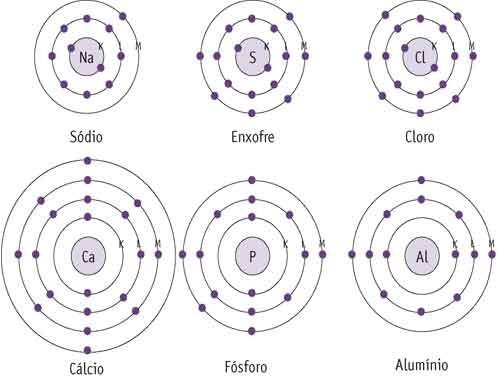
Qual é camada de valência de cada um desses átomos?
A camada de valência é sempre a mais externa, as camadas são identificadas por letras e a mais próxima do núcleo é a camada K.
Confira nos esquemas a quantidade de elétrons existentes na camada de valência dos átomos.
Regras para a distribuição eletrônica nas camadas.
1.a) Distribuir os elétrons, observando a quantidade máxima em cada camada.
Lembre-se:
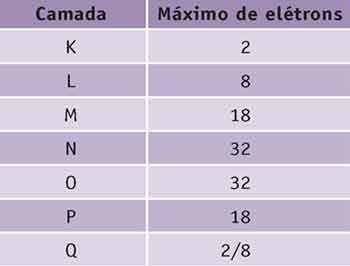
2.a) Após a distribuição eletrônica, observar a última camada. Qualquer que seja, ela não comporta mais que 8 elétrons.
Caso tenha, tirar a quantidade e colocar 18 ou 8, o que for imediatamente inferior. A diferença deve ser colocada na próxima camada.
Exemplos de distribuição dos elétrons:
- a) Na (Z = 11): K-2; L-8; M-1.
- b) Ca (Z = 20):
1.a distribuição: K-2; L-8; M-10 (não pode mais que oito).
Distribuição final: K-2; L-8; M-8; N-2.
- c) Te (Z = 52).
1.a distribuição: K-2; L-8; M-18; N-24 (não pode mais que oito).
Distribuição final: K-2; L-8; M-18; N-18; O-6.
Sódio (Na) -► 1
Enxofre (S) -► 6
Cloro (Cl) -► 7
Cálcio (Ca) -► 2
Fósforo (P) -► 5
Alumínio (Al) -► 3
Podemos separar esses e muitos outros elementos químicos em dois conjuntos:
■ aqueles que possuem um, dois ou três elétrons na camada de valência;
■ aqueles que possuem cinco, seis ou sete elétrons na camada de valência.
Os que possuem poucos elétrons têm tendência a perder esses elétrons e os que têm muitos tendem a ganhar elétrons até chegar a oito (regra do octeto).
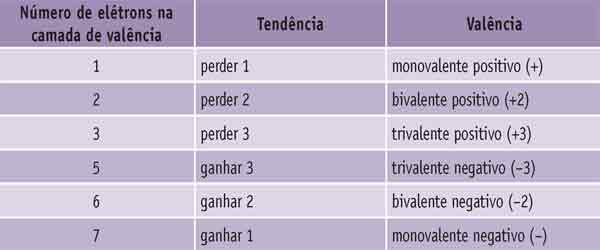
Valência dos átomos
Nós aprendemos que, em condições normais, um átomo sempre tem o mesmo número de prótons e de elétrons e, por isso, eles são neutros.
Mas há situações em que esse equilíbrio de cargas elétricas pode ser alterado. Quando um átomo perde ou ganha elétrons, ele recebe o nome de íon.
Os íons podem ser positivos, recebendo o nome de cátions, ou negativos, recebendo o nome de ânions.
Veja de que modo um átomo se torna um íon positivo (cátion):
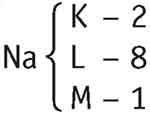
O sódio em condição normal possui 11 prótons e 11 elétrons e por isso é neutro, mas para formar um composto ele tende a perder o elétron da camada de valência, ficando então, com 11 prótons e 10 elétrons.
Se colocarmos os valores das cargas elétricas dos átomos em uma conta bem simples, veremos que o sódio se torna um íon positivo, ele é um elemento monovalente positivo.
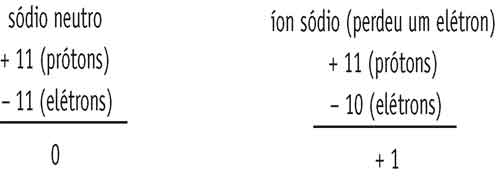
Agora veja como um átomo se torna um íon negativo (ânion):
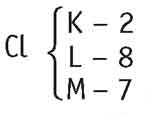
O cloro, em condição normal, possui 17 prótons e 17 elétrons e, por isso, é neutro. Para formar um composto, ele tende a ganhar um elétron, de modo a ficar com oito elétrons na camada de valência, ficando então com 17 prótons e 18 elétrons.
Se colocarmos os valores das cargas elétricas em uma conta bem simples, veremos que o cloro se torna um íon negativo, ou seja, ele é um elemento monovalente negativo.
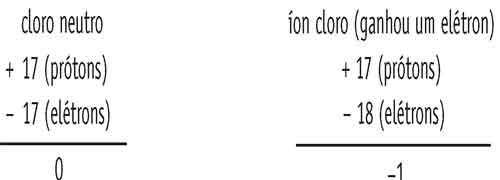
Com base nos exemplos anteriores, podemos generalizar o comportamento de muitos átomos e o tipo de íons que formam.
Observação:
Os elementos com quatro elétrons periféricos não perdem nem ganham elétrons, eles compartilham pares eletrônicos. Veremos isso logo adiante.
Pois bem, os átomos em desequilíbrio elétrico (íons) tendem a se aproximar, formando compostos. Nesse caso, as ligações químicas formadas recebem o nome de ligações iônicas.
Lembre-se! O elemento que perde elétrons fica positivo; o elemento que ganha elétrons fica negativo; o íon positivo recebe o nome de cátion; o íon negativo recebe o nome de ânion.
Tipos de ligações Químicas
As ligações químicas podem ser basicamente de três tipos:
- Ligação iônica
- Ligação covalente
- Ligação Metálica
Vejamos agora em mais detalhes cada um desses tipos de ligações
Ligação iônica
Como o nome sugere, são as ligações que se formam pela atração de íons de cargas opostas.
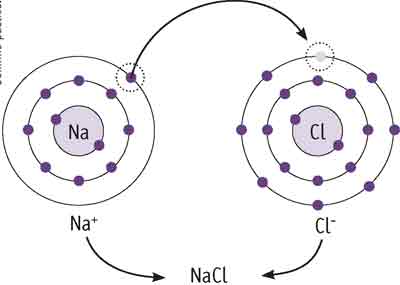
Para entender a ligação iônica, vamos usar como exemplo os átomos de cloro e sódio. Já vimos que o cloro possui sete elétrons em sua camada mais externa e que o sódio possui um.
Quando esses dois elementos se encontram, os sete elétrons do cloro “retiram” o último elétron do sódio.
Surgem então dois íons, o cloro (Cl–) e o sódio (Na+), que se mantêm unidos pela atração de suas cargas opostas.
Essa união forma um composto iônico, também denominado retículo cristalino, que pode ser representado da seguinte maneira: NaCl (cloreto de sódio).
É o nosso conhecido sal de cozinha, cuja estrutura tridimensional é aquela da imagem do início do capítulo.
Os íons que compõem o cloreto de sódio se arrumam geometricamente, formando pequenos cristais cúbicos.
Perceba que cada íon de cloro está sempre na extremidade de uma aresta e na outra ponta há um íon de sódio. Esse arranjo se faz pela atração das cargas opostas dos íons em questão.
Ligação covalente
Vimos que a ligação iônica acontece entre átomos em que um tende a ganhar elétrons e o outro tende a perdê-los.
De um modo bem simplificado, poderíamos dizer que a ligação covalente acontece entre átomos que têm tendência a ganhar elétrons.
Porém, como não é possível que todos ganhem, as ligações covalentes se fazem por compartilhamento de pares eletrônicos, isto é, cada átomo “empresta” um, dois, três ou quatro elétrons, os quais emparelham com os elétrons de outro formando uma “nuvem” que mantém os átomos fortemente unidos.
As ligações covalentes produzem moléculas. Veja alguns exemplos.
Formação do gás hidrogênio (H2)
Cada átomo de hidrogênio possui apenas um elétron na camada K (sabemos que ela se estabiliza com dois) e, portanto, o hidrogênio tende a ganhar um elétron. Quando dois átomos de
H estão próximos, os dois “gostariam de ganhar” um elétron, porém isso não é possível. Então, há um compartilhamento de elétrons (isto é, os elétrons compartilhados passam a fazer parte dos dois átomos ao mesmo tempo, surgindo uma “nuvem” que os envolve e mantém firmemente unidos). Observe o esquema.
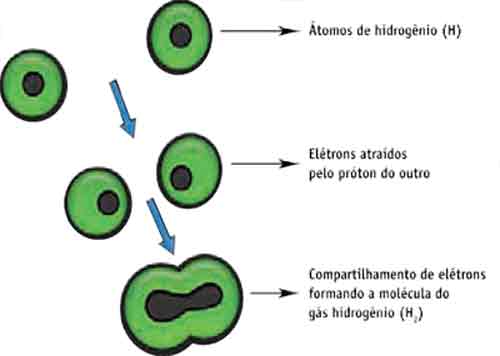
Como houve a formação de um par eletrônico, dizemos que o hidrogênio é monovalente. Formação do gás metano (CH4)
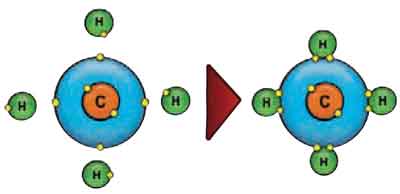
Processo semelhante acontece com todos os compostos que fazem ligação co-valente. 0 metano é um exemplo. O carbono possui quatro elétrons em sua camada de valência e portanto “gostaria” de ganhar quatro elétrons.
Ao se unir ao hidrogênio, cada átomo desse elemento “empresta” um elétron ao carbono, o qual por sua vez “empresta” um elétron para cada átomo de hidrogênio.
Veja no esquema: surgem quatro pares de elétrons compartilhados. Por isso, dizemos que o carbono é tetravalente.
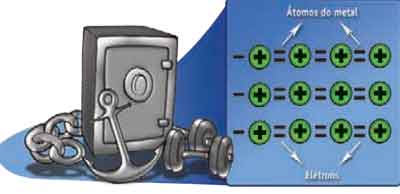
Ligação metálica
Como o nome sugere, acontece entre átomos de metal que, ao se unirem, formam um retículo cristalino.
A ligação se faz pelo aparecimento de uma “nuvem de elétrons livres” que envolve os átomos e que não pertence a nenhum deles em especial.
Para os cientistas, a presença dessa nuvem explica a boa condutividade que os metais apresentam em relação à eletricidade, e explica a maleabilidade (capacidade de serem transformados em lâminas) e a ductibilidade (capacidade de serem transformados em fios).
Exercícios sobre ligação química e distribuição eletrônica
- Quando o átomo de cloro se une ao átomo de magnésio para formar o cloreto de magnésio, que tipo de ligação química acontece entre os dois?
Solução:
O cloro possui sete elétrons em sua camada de valência, portanto, tem tendência a ganhar um elétron. O magnésio tem dois elétrons na camada de valência, portanto, tem tendência a perder elétrons. Quando o composto se forma entre um átomo que
ganha e outro que perde elétrons, a ligação formada entre eles é iônica.
Assinale com um X a única alternativa correta.
- Todos os termos abaixo se referem a partículas subatômicas (componentes do átomo), exceto o:
- a) próton.
- b) elétron.
- c) íon.
- d) nêutron.
- A camada de valência de todos os gases raros (nobres), exceto do hélio, possui:
- a) seis elétrons.
- b) cinco prótons.
- c) oito nêutrons.
- d) dois elétrons.
- e) oito elétrons.
- Uma molécula poderia ser formada por qualquer um dos elementos abaixo, exceto pelo:
- a) carbono (C).
- b) hidrogênio (H).
- c) oxigênio (O).
- d) neônio (Ne).
- e) nitrogênio (N).
- Diferencie ligação iônica de ligação covalente.
- Observe a fórmula NaF. Consulte a tabela periódica e responda.
- a) Que tipo de ligação ocorre entre os elementos sódio (Na) e flúor (F)?
- b) Justifique sua resposta.
- c) A substância NaF é um composto iônico ou uma molécula?
- Considere o elemento de número atômico (Z) 13. Observe sua configuração eletrônica (distribuição eletrônica em camadas). Qual a valência desse elemento quando ocorre ligação iônica?
- O que deve acontecer ao átomo de número atômico 34 para que ele adquira a configuração eletrônica de um gás nobre?
- O que diz a regra do octeto?
- O que é uma ligação metálica? Que tipos de elementos formam essas ligações?
- Um aluno, ao fazer prova de Ciências, assinalou como correta uma alternativa em que se afirmava que o magnésio e o flúor eram elementos capazes de produzir cátions. Ele acertou em sua escolha? Justifique.
Veja também
Referências Bibliográficas
STRATHERN, Paul. O Sonho de Mendeleiev: a verdadeira história da química. Rio de Janeiro: Jorge Zahar, 2000. – Link
OLIVEIRA, Lívia Micaelia Soares; DA SILVA, Oberto Grangeiro; DA SILVA FERREIRA, Ulysses Vieira. Desenvolvendo jogos didáticos para o ensino de química. Holos, v. 5, p. 166-175, 2010 – Link
Sugestões de sites:
CENTRO de Divulgação Científica e Cultural da USP. Tabela Periódica. Disponível em: <www.cdcc.sc.usp.br/quimica/tabelaperiodica1.htm>.
INSTITUTO Ciência Hoje. Revista Ciência Hoje, CH 198. Disponível em: <www.cienciahoje.uol.com.br/390>.

Estou muito grato com a matéria fornecida e espero que continue assim para melhoramento dos meus estudos em Engenharia, porque tenho muito que buscar mas conhecimento em investigar o que diz respeito a Química, me foi muito útil a informação e esta muito detalhada e recomendo que haja mas colegas buscando essa informação