Tabela Periódica completa – Elementos químicos
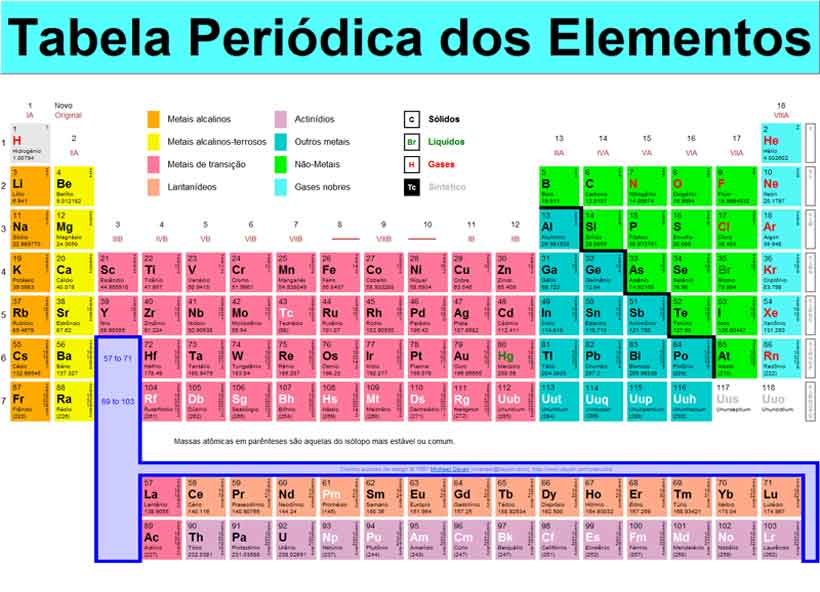
Todos os elementos químicos que conhecemos estão organizados em uma tabela periódica. A tabela periódica mostra a disposição organizada e ordenada por números atômicos dos elementos químicos.
Além do número atômico os elementos apresentam outras propriedades periódicas, como raio atômico, potencial de ionização e raio atômico por exemplo.
A tabela periódica usada atualmente passou por algumas modificações e nela os elementos estão agrupados em ordem crescente de número atômico (Z).
Tabela periódica dos elementos

Sobre cada elemento químico, a tabela periódica nos dá muitas informações, indicadas em cada quadrado. As tabelas têm um quadradinho padrão mostrando as informações que ali estão contidas.
Veja, o quadrado-referência nos diz que esta tabela periódica traz as seguintes informações:
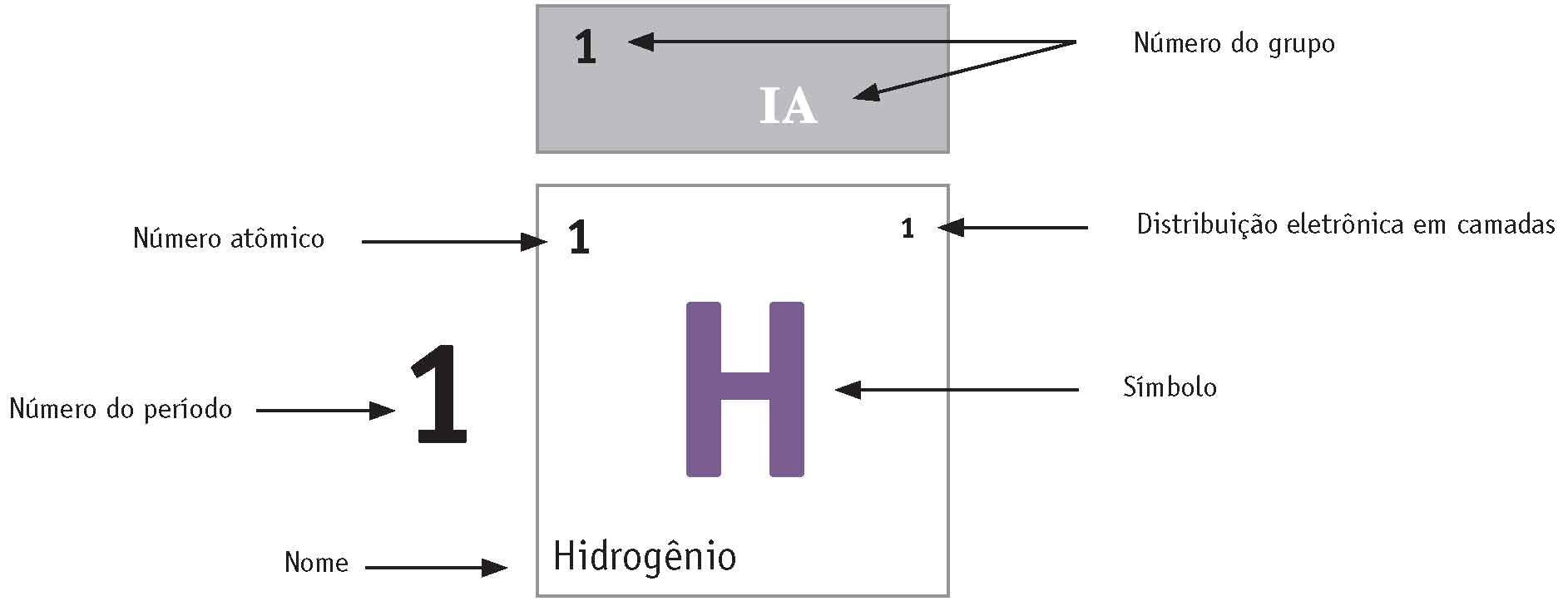
Então, interpretando essa quadrícula, podemos saber que o hidrogênio tem símbolo H, possui número atômico 1, seu único elétron ocupa a primeira camada eletrônica, K=1. Sabemos também que ele é um elemento gasoso por meio da informação dada pela cor do símbolo, de acordo com convenção adotada e informada pela tabela.
Mas além dos quadrados você percebe que há linhas horizontais e colunas verticais. As sete linhas são denominadas períodos e as 18 colunas recebem o nome de grupos ou famílias. Os grupos eram indicados pela representação IA, IIA, IB…, mas atualmente há a tendência de identificá-los apenas com a numeração de 1 a 18 (nossa tabela mostra as duas representações).
Os períodos
Elementos que fazem parte de um mesmo período têm o mesmo número de camadas eletrônicas ao redor de seus núcleos.
O sexto e o sétimo períodos possuem elementos que são representados separadamente, para maior comodidade na leitura. O período 6 contém a série dos lantanídeos e o período 7 contém a série dos actinídeos.
Vamos observar o período 4. Nele, encontramos o potássio, o cálcio, o escândio, o titânio… Agora, preste atenção e olhe em cada quadrícula da coluna à direita: em todas elas vemos quatro camadas ou níveis. Então, os elementos do período 4 possuem quatro níveis de elétrons, os elementos do período 6 possuem seis níveis de elétrons e assim por diante. Confira: olhe cada nível e a quantidade de camadas ao redor do núcleo.
As colunas, grupos ou famílias
Algumas famílias têm nomes especiais. Veja:
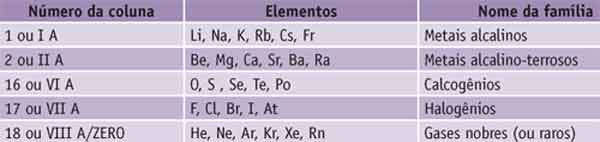
Você percebeu que ao listarmos os elementos da coluna 1 não citamos o hidrogênio?
Não foi esquecimento. O motivo é que ele não é um metal alcalino: é um elemento gasoso e possui propriedades tão diferentes dos demais elementos que, em algumas representações, é colocado fora da tabela.
Quando a família não tem um nome especial, é comum citá-la pelo nome do primeiro elemento que nela aparece. Por exemplo, na coluna 13, o primeiro elemento é o boro, então dizemos que a coluna 13 é a coluna da família do boro.
As colunas A são as mais importantes, seus elementos são denominados característicos ou representativos e têm grande semelhança de propriedades químicas.
As colunas B são dos elementos de transição.
Obs.: para as famílias A, o seu número é o número de elétrons do elemento na última camada (camada de valência).
Metais, semimetais, não metais e gases nobres
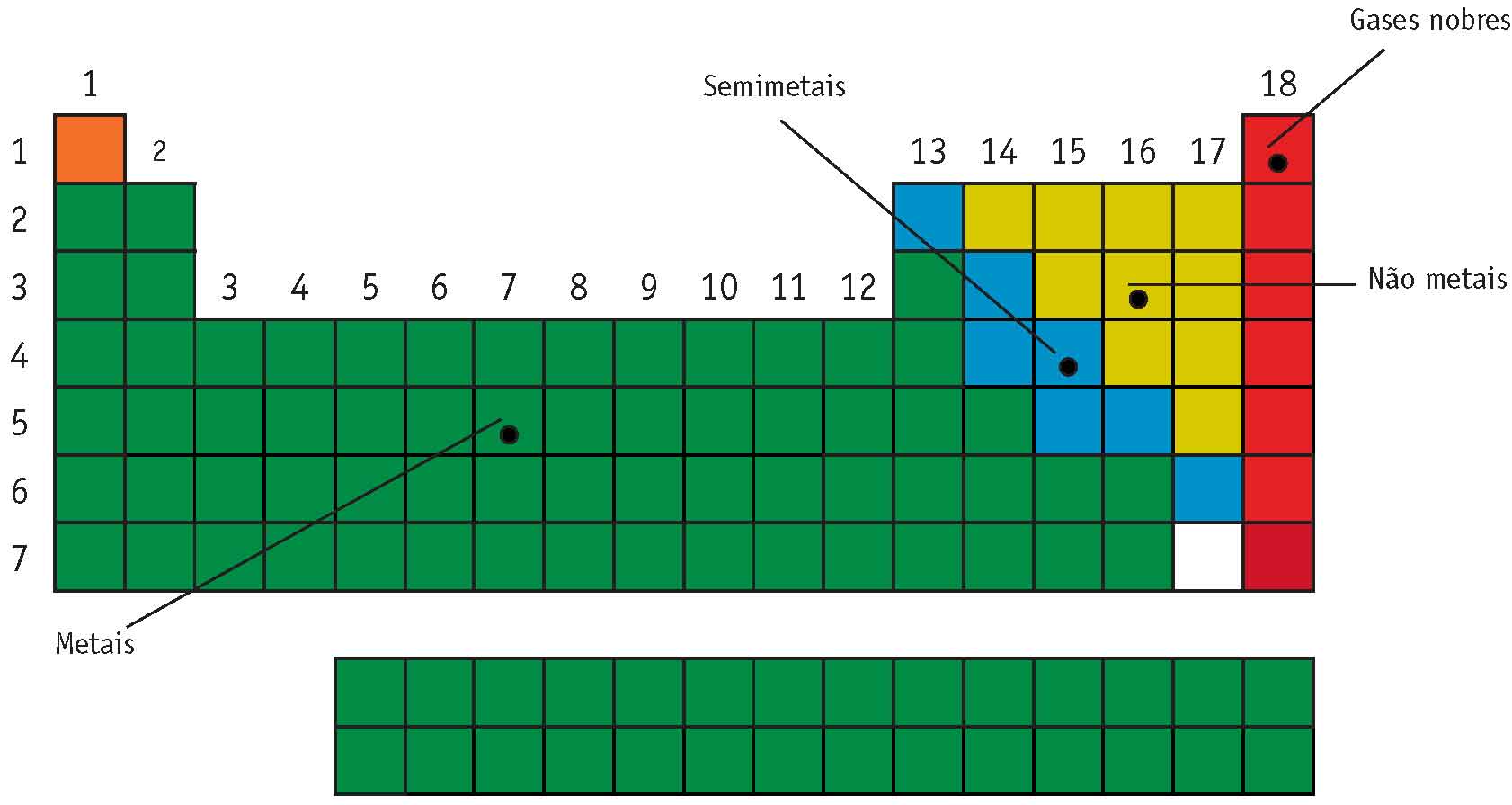
Observe o esquema. Nele estão representadas as quadrículas vazias com as cores que nos permitem saber se o elemento é um metal, um semimetal, um não metal ou um gás nobre. Cada um desses grupos possui características próprias:
■ Metais -► são os mais numerosos. Existem 84 elementos metálicos. São sólidos, (com exceção do mercúrio que é líquido à temperatura ambiente), geralmente duros, maleáveis (podem ser transformados em lâminas), dúcteis (podem ser transformados em fios), conduzem bem o calor e a eletricidade e têm brilho metálico. Por exemplo: o alumínio, o ouro, a prata, o cobre.
■ Semimetais -► são sete elementos que têm propriedades intermediárias entre metais e não metais. Eles servem de “divisória” entre metais e não metais. São o boro, o silício, o germânio, o arsênio, o antimônio, o telúrio e o polônio.
■ Não metais -► são 11 elementos: (carbono, nitrogênio, oxigênio, flúor, fósforo, enxofre, cloro, selênio, bromo, iodo e astato) e têm propriedades opostas às dos metais.
■ Gases nobres ou raros -► são os seis elementos da coluna 18, também denominados elementos inertes por sua dificuldade em formar compostos com outros elementos.
De todos os 109 elementos, 92 são naturais, isto é, são encontrados na natureza, e os demais foram produzidos artificialmente em laboratório. Os primeiros receberam nomes que lembravam os planetas, como o netúnio e plutônio, depois, foram dados nomes que estavam relacionados a continentes, cidades e cientistas. Os nomes são submetidos a convenções internacionais até serem aprovados e usados mundialmente.
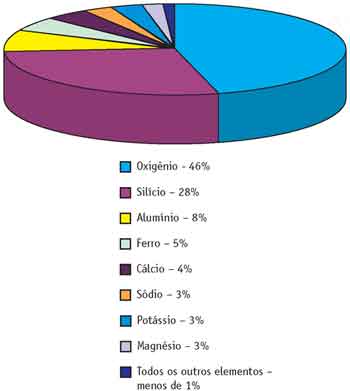
O gráfico representa a frequência dos elementos químicos mais abundantes na crosta terrestre. Você pode observar que entre os mais de cem elementos, apenas oito compõem cerca de 99% da crosta – portanto, todos os outros formam o 1% restante. Então, podemos concluir que alguns elementos são muito raros.
O que é um elemento químico
Elemento químico é o conjunto de átomos de mesmo número atômico (Z).
Os mais de cem elementos podem ser representados por símbolos químicos.
Assim como a nomenclatura científica dos seres vivos, os símbolos químicos e as fórmulas das substâncias são uma linguagem universal. Por exemplo: H2O é o símbolo da água em qualquer parte do mundo, independentemente do idioma e do alfabeto usado ali.

Nessa imagem, há símbolos do alfabeto japonês que nos são incompreensíveis, porém, o símbolo da água é bem claro.
Você já viu os símbolos químicos anteriormente, então vamos entender qual a origem deles e porque alguns parecem tão ligados ao nome do elemento enquanto outros, aparentemente, não têm qualquer relação com os nomes pelos quais os conhecemos.
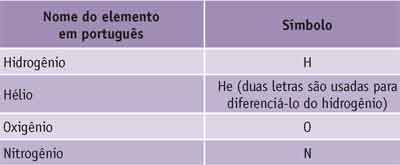
Muitos nomes dos elementos provêm do latim e o símbolo é a primeira letra do nome em latim. Porém, alguns elementos têm o nome iniciado pela mesma letra e nesse caso é acrescentada uma segunda para diferenciá-los. A primeira letra é escrita em maiúscula e a segunda (quando houver) em minúscula.
Nosso idioma é de origem latina e assim muitos dos símbolos usados para identificar os elementos correspondem ao nome que eles têm em português. Veja:
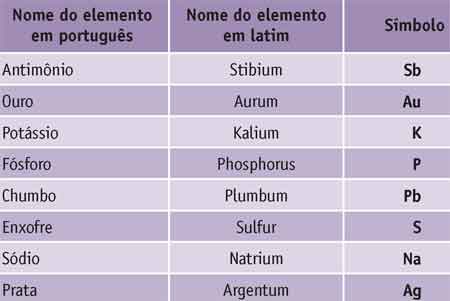
Alguns elementos, no entanto, possuem um símbolo muito diferente do nome em português porque o nome em latim é muito diferente daquele que nós usamos. Veja:
Os elementos químicos estão reunidos formando uma tabela, a tabela periódica, que foi organizada inicialmente pelo pesquisador russo Dimitri Mendeleiev (1834-1907). Sobre a forma como foi concebida, ele mesmo relatou: “Vi num sonho uma tabela em que todos os elementos se encaixavam. Ao despertar, escrevi-a imediatamente numa folha de papel.”
Naquele momento, eram conhecidos 63 elementos, que foram agrupados de acordo com suas características.
Não se deve creditar ao acaso, porém, a descoberta de Mendeleiev: a história registra que, quando teve o sonho que lhe teria revelado a solução para o problema, o químico russo já trabalhava sobre a questão por exaustivos três dias.
Exercícios e atividades
1. Um elemento do grupo 14 se encontra no terceiro período da tabela periódica. Quem é ele? Qual seu símbolo? Qual o percentual desse elemento na crosta terrestre?
Solução:
Analisando a tabela periódica, verificamos que o grupo 14 é formado pelos elementos carbono, silício, germânio, estanho e chumbo. No terceiro período encontramos o silício (Si) que, de acordo com a tabela do início do módulo, constitui 28% da crosta terrestre.
Complete.
1. Na atual tabela periódica, os elementos encontram-se rigorosamente em ordem crescente de_.
2. Um elemento que esteja no terceiro período possui_camadas eletrônicas.
3. A coluna 2 recebe o nome de família dos metais_.
4. Consulte a tabela periódica e dê o nome dos elementos abaixo.
Pb _ N -►__K -►_
Sb -►__P -►__Ba -►_
Na -►_ Se -►__F -►_
S -►_ Au -►_ Mn -►_
Li -►__O -►__Ni -►_
C -►__B -►__Ag -►_
Ca -►__Mg -►__Fe -►_
5. Consulte a tabela periódica e escreva o símbolo dos elementos abaixo.
nitrogênio -►_ fósforo -► _ bário -► _
hélio -► _ polônio -► _ molibdênio -► _
prata -► _ germânio -► _ enxofre -► _
chumbo -► _ bromo -► _ berílio -► _
ouro -► _ césio -► _ flúor -► _
sódio -► _ cálcio -► _ hidrogênio -► _
cloro -► _ estrôncio -► _ oxigênio -► _
6. Qual o número atômico do terceiro elemento da família dos metais alcalino-terrosos? Quantos elétrons ele possui? Como eles estão distribuídos nas diversas camadas?
8. Existe um metal que à temperatura ambiente é líquido. Que metal é esse? Qual seu número atômico?
9. Qual a classificação de um elemento cujo número atômico é 18?
10. Cite três características dos metais.
11. Qual é o nome da série de elementos de números atômicos de 57 a 71?
12. Quais são os elementos do segundo período da tabela periódica?
A associação correta é:
a) I – c ; II – b ; III – b ; IV – d ; V – e.
b) I – h ; II – c ; III – c ; IV – a ; V – g.
c) I – e ; II – f ; III – f ; IV – h ; V – d.
d) I – f ; II – c ; III – c ; IV – h ; V – g.
e) I – h ; II – b ; III – b ; IV – f ; V – h.
17. Átomos de elementos químicos que se encontram no mesmo período possuem mesmo número:
a) de átomos.
b) de moléculas.
c) de camadas.
d) de folhas.
e) de rascunhos.
18. Os elementos do terceiro período da tabela periódica apresentam:
a) 3 elétrons na camada de valência.
b) 3 camadas eletrônicas.
c) massas iguais.
d) números atômicos iguais.
e) o mesmo número de elétrons.
Referências bibliográficas
MEHLECKE, Clarissa de Mattos et al. A abordagem histórica acerca da produção e da recepção da Tabela Periódica em livros didáticos brasileiros para o ensino médio. Revista Electrónica de Enseñanza de las Ciencias, v. 11, n. 1, 2012 – Link