Estrutura Atômica: estrutura do átomo – partículas – resumo
Entender a estrutura atômica é entender como é a matéria. Podemos definir basicamente a estrutura do átomo em três partículas fundamentais: elétron, próton e nêutron.
Entender a estrutura atômica nos permitirá compreender muitos dos fenômenos cotidianos que nos cercam.
O que é um átomo?
O termo átomo é antigo: foi criado pelos filósofos gregos, significando “aquele que não pode ser dividido”.
Sabemos, hoje, que os átomos são formados por partículas menores – portanto, eles não são indivisíveis como pensavam os gregos antigos. Apesar disso, o termo continua a ser usado para designar as partículas que formam a matéria.
Para chegarmos ao modelo atômico aceito atualmente pelos cientistas, um longo caminho de pesquisas e teorias foi trilhado. Muitas vezes, o caminho se mostrou sem saída, outras vezes, porém, levou aos conhecimentos que temos hoje.
No início do século XX, dois cientistas, o neozelandês Ernest Rutherford (1871-1937) e o dinamarquês Niels Bohr (1885-1962), pesquisavam a estrutura atômica e seus trabalhos permitiram que se entendesse a organização de um átomo.
Rutherford montou um experimento semelhante ao esquema abaixo. Nele, um material radioativo emitia partículas alfa que deveriam atravessar uma fina lâmina de ouro.
Essa lâmina estava rodeada por um anteparo pintado com uma tinta especial que emitia um ponto luminoso sempre que fosse atingida por uma partícula alfa.
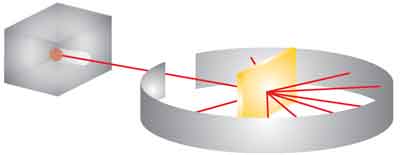
Para surpresa de muitos, as partículas alfa pareciam atravessar a lâmina de ouro sem que nada houvesse ali.
De posse dessa observação, Rutherford concluiu que o átomo não é maciço, tendo muito espaço vazio.
A maior parte da massa do átomo está no núcleo, onde há prótons, partículas com carga elétrica positiva.
Ao redor do núcleo, há uma nuvem de partículas, a eletrosfera, formada por partículas muito pequenas e de carga elétrica negativa, os elétrons.
Bohr afirmava que os elétrons deveriam estar dispostos ao redor do núcleo, em órbitas ou camadas, à semelhança do sistema solar.
Em 1932, James Chadwick (1891-1974) descobriu mais uma partícula, o nêutron, também integrante do núcleo. Porém, diferentemente dos prótons, ele não possui carga elétrica.
Depois da descoberta dos nêutrons, muitas outras partículas subatômicas foram descritas e muitos modelos foram propostos, porém será o modelo de Rutherford-Bohr que usaremos em nossos estudos.
O modelo de Rutherford-Bohr
Como já dissemos, nesse modelo o átomo é formado por uma parte central, o núcleo, onde existem dois tipos de partículas: os prótons e os nêutrons.

Em um átomo, a quantidade de prótons (cargas elétricas positivas) é igual à quantidade de elétrons (cargas elétricas negativas) – por isso o átomo é eletricamente neutro.
Cada átomo possui um número característico de prótons e elétrons.
Ao compararmos os prótons e os nêutrons aos elétrons, veremos que prótons e nêutrons têm massa muito maior. Então, os cientistas dizem que prótons têm massa igual a 1 (um), nêutrons têm massa igual a 1 (um) e elétrons têm massa desprezível (1/1 840).
Os elétrons se dispõem em órbitas ao redor do núcleo.
Essas órbitas, denominadas camadas ou níveis de energia, são identificadas pelas letras: K, L, M, N, O, P, Q. Cada camada pode conter um número máximo de elétrons (veja na tabela abaixo).
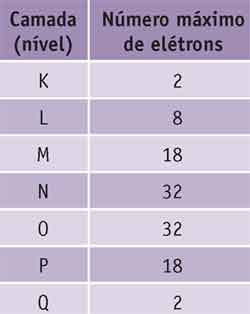
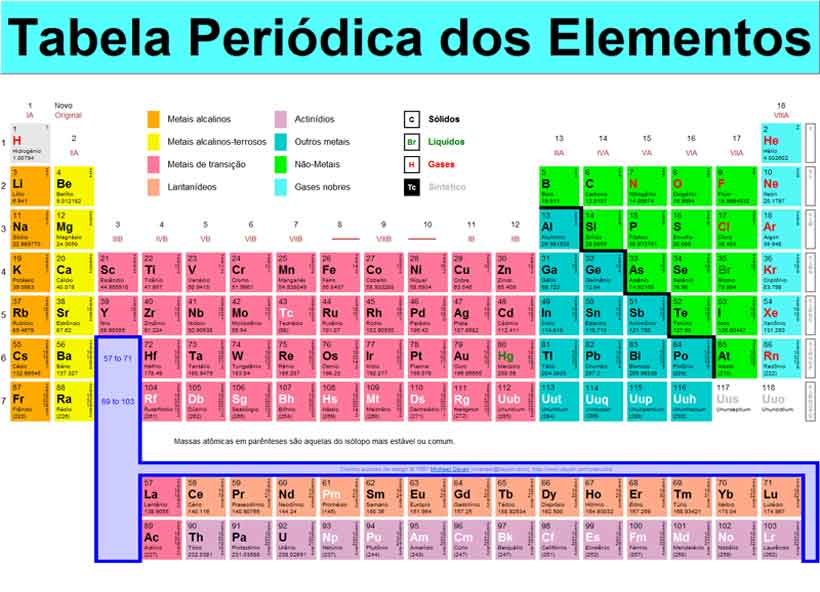
A distribuição dos elétrons nas camadas pode ser encontrada na tabela periódica, que será o assunto do próximo módulo.
A quantidade das partículas atômicas define os conceitos de número atômico (Z) e número de massa (A).
Número atômico
Número atômico (Z) é a quantidade de prótons existentes no núcleo de um átomo.
O número atômico caracteriza cada tipo de átomo, isto é, cada tipo de elemento químico. Um elemento químico é o conjunto de átomos com mesmo número atômico, ou seja, com mesma quantidade de prótons.
A tabela abaixo mostra todos os elementos químicos com seus respectivos símbolos e números atômicos. Os símbolos são formas abreviadas de representar os diversos elementos (mais adiante, veremos a origem desses símbolos e a forma correta de empregá-los).
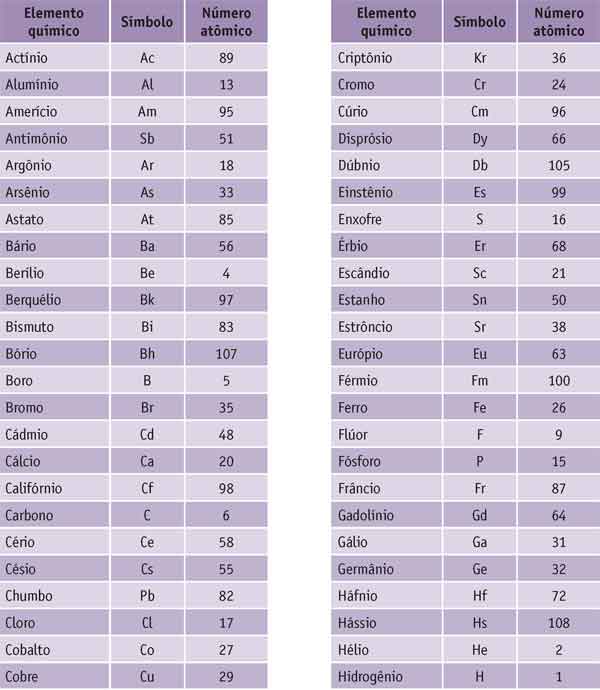
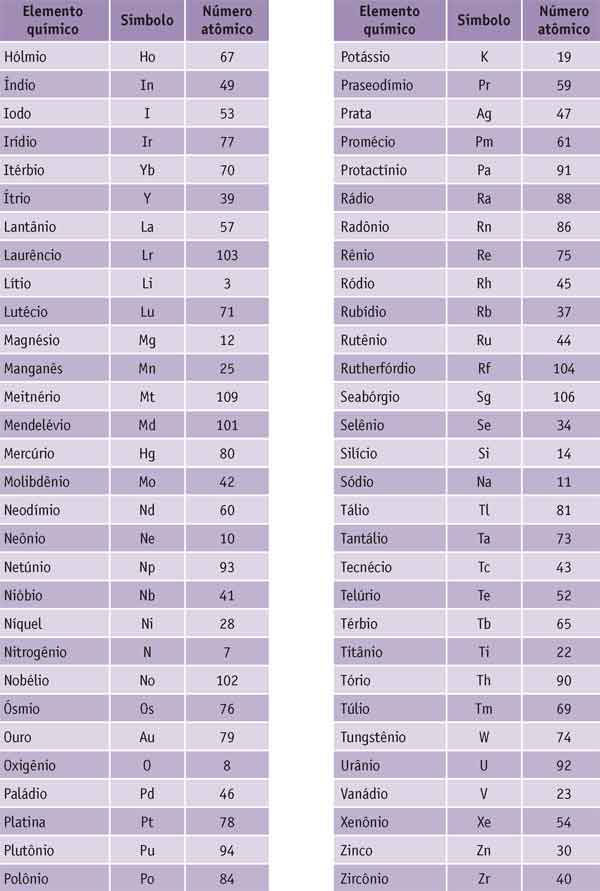
Como você pode observar, cada elemento químico tem seu número atômico específico: o elemento de Z=1 é o hidrogênio, o elemento de Z=2 é o hélio e assim por diante – nenhum tem valor de número atômico igual a outro.
Número de massa
Para comparar massas de diferentes átomos, podemos calcular o número de massa. Para isso, devemos levar em consideração apenas as partículas que têm massa considerável.
Os elétrons, como vimos, têm massa tão pequena que seriam necessários cerca de 1 840 deles para termos a massa de um próton.
Portanto, eles não entram nesse cálculo. Até porque, se você observar bem a lista anterior, verá que o maior átomo possui somente 109 prótons, possuindo apenas 109 elétrons, quantidade que não chega nem perto da massa de um único próton.
Número de massa (A) é a soma do número de prótons (Z) e de nêutrons (N) existentes no núcleo de um átomo.
O número de massa pode ser expresso pela equação:
A = Z + n
Os diferentes elementos químicos podem apresentar certas relações entre si, como os fenômenos de isotopia, isobaria e isotonia.
Isotopia – átomos isótopos
Na natureza, podemos encontrar átomos que possuem o mesmo número atômico (Z), mas diferente número de massa (A).
Perceba que, tendo o mesmo número atômico, eles compõem um mesmo elemento químico – o que varia é a quantidade de nêutrons em seus núcleos. O elemento carbono possui três isótopos:
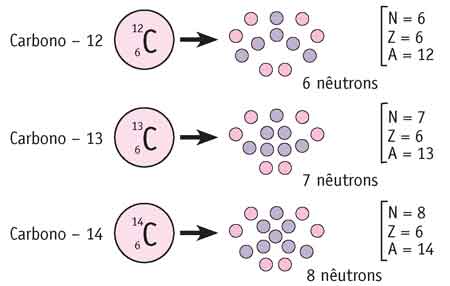
Observe, atentamente, o exemplo e fixe os conceitos de número atômico -► quantidade de prótons; número de massa -► soma de prótons e nêutrons.
Observe também a forma como esses valores foram colocados junto ao símbolo químico do elemento carbono.

Isobaria – átomos isóbaros
Átomos de diferentes elementos químicos podem possuir o mesmo número de massa. Nesse caso, dizemos que os dois são isóbaros.
Veja um exemplo:

Os átomos de chumbo e platina têm o mesmo número de massa (A), mas possuem diferentes números atômicos (Z). Portanto, podemos dizer que eles são isóbaros e são átomos de diferentes elementos químicos porque têm diferente número atômico (Z).
Isotonia – átomos isótonos
São os átomos de diferentes elementos químicos que têm diferentes números de massa, mas possuem a mesma quantidade de nêutrons. Veja:

Sabendo que o número de massa (A) é a soma de prótons e nêutrons, se diminuirmos de (A) a quantidade de prótons (Z), teremos o número de nêutrons em cada exemplo. Então, o potássio (K) terá: 39 – 19 = 20 nêutrons e o cálcio (Ca) terá: 40 – 20 = 20 nêutrons. Portanto, podemos dizer que um em relação ao outro é isótono.
Exercícios Resolvido
1. O urânio pode ser encontrado nas formas U238 e U235. Cite as semelhanças e diferenças que elas apresentam quando levamos em consideração o número de partículas atômicas que as compõem.
Solução:
As duas formas de urânio são isótopos desse elemento, isto é, as duas possuem mesmo número de prótons (Z) e por isso compõem um mesmo elemento químico, sendo representadas pelo símbolo U. O U238 possui três nêutrons a mais do que o U235.
Exercícios e atividades
1. O número de prótons de qualquer átomo é_ao número de elétrons
e como consequência o átomo é eletricamente__
2. A soma de prótons mais nêutrons é chamada_,
indicada pela letra__
3. O átomo de mercúrio 28000Hg é formado por____prótons, _____ nêutrons e____elétrons.
4. Em uma experiência imaginária, um indivíduo resolveu construir o átomo de um elemento químico. Para isso, ele tinha sete prótons, dez elétrons e oito nêutrons. Qual deveria ser o número máximo de partículas a serem colocadas na eletrosfera desse átomo? Justifique.
6. O elemento químico urânio possui os isótopos 234U, 235U, 236U, sendo seu número atômico (Z) igual a 92. Qual será o número de nêutrons de cada isótopo? Por que todos os isótopos são representados pelo mesmo símbolo U?
7. Como é o átomo do modelo de Rutherford-Bohr?
8. Os elétrons se dispõem em camadas ao redor do núcleo do átomo. Quantas e quais são as camadas existentes?
9. O que é elemento químico?
Constituem um par de isóbaros:
a)I e II.
b) I e III.
c) II e III.
d) II e IV.
e) III e IV.
10. Com relação à estrutura do átomo, assinalar a alternativa correta:
a) O átomo é maciço.
b) A massa do átomo está fundamentalmente concentrada no seu núcleo.
c) No núcleo encontram-se prótons e elétrons.
d) A massa do elétron é igual à massa do próton.
e) Átomos de um mesmo elemento químico são todos iguais.
11. Os átomos X e Y são isótopos e apresentam as seguintes características:
X 3A Y 3A-2
A+5 2A-10
Os números de massa de X e Y são, respectivamente:
a) 45 e 43.
b) 45 e 41.
c) 43 e 43.
d) 43 e 41.
e) 41 e 40.
12. São dadas as seguintes informações relativas aos átomos X, Y e Z:
I. X é isóbaro de Y e isótono de Z.
II. Y tem número atômico 56, número de massa 137 e é isótopo de Z.
III. O número de massa de Z é 138.
O número atômico de X é:
a) 53
b) 54
c) 55
d) 56
e) 57
13. Sejam os elementos 53A110, B e C, de números atômicos ímpares consecutivos e crescentes na ordem dada. Sabendo-se que A e B são isóbaros e que B e C são isótonos, determine:
a) o número de massa do elemento C;
b) o número de nêutrons de B.
Referências Bibliográficas:
- MARQUES, Deividi Marcio; CALUZI, João José. Ensino de Química e História da Ciência: o modelo atômico de Rutherford. ENCONTRO NACIONAL DE PESQUISA EM EDUCAÇÃO EM CIÊNCIAS–EMPEC, v. 4, 2003 – Link