Estados físicos da matéria – mudança de estado físico

Os três estados físicos da matéria podem são basicamente três: sólido. líquido e gasoso. Obviamente existem outros estados que a matéria pode assumir, mas nesse artigo vamos nos concentrar nos detalhes desses três.
Você já sabe que tudo o que existe é formado por matéria e, também, que ela está sujeita a fenômenos diversos. Na natureza, a matéria pode ser encontrada em três estados físicos: sólido, líquido e gasoso.
A água é a matéria que geralmente usamos para estudar as mudanças de estado físico. Veja o vídeo abaixo e depois continue a leitura.
Os três estados físicos da matéria
Os três estados físicos da matéria mais comum são o sólido, líquido e gasoso. Vejamos então esses três estados em mais detalhes.
Estado sólido
Você sabe citar exemplos de substâncias no estado sólido? Olhe ao seu redor e anote três exemplos. Por que você escolheu esses objetos? Qual fator lhe diz que eles estão no estado sólido?
Provavelmente, uma das características levadas em consideração foi a rigidez (solidez ficaria muito redundante, não é?) desses materiais, ou seja, um sólido tem forma invariável. Coloque sua borracha em cima da mesa.
Que forma ela tem? Agora, jogue-a para cima ou vá lá fora e deixe-a sobre uma pedra. Ela continuará com a mesma forma.
Nada do que você fez alterou a forma ou o volume da borracha. Por isso, dizemos que, sob condições constantes de pressão e temperatura, os sólidos têm forma invariável e mantém o mesmo volume.
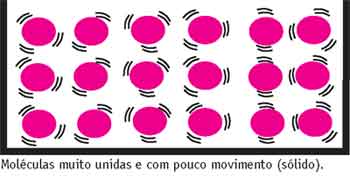
Um sólido é tão rígido em sua forma e volume porque existe uma força muito intensa unindo (atraindo) as moléculas ou os átomos que o compõem. É a força de coesão ou de atração.
Essa força de atração tão forte faz com que as partículas dos sólidos estejam muito próximas e possuam pouca movimentação e estejam muito organizadas.
Estado Líquido
Diferentemente de um sólido, os líquidos não têm forma constante. Eles assumem a forma do recipiente em que estão contidos e, em iguais condições de pressão e temperatura, o volume não varia.
Veja um exemplo. Pegue uma garrafa de refrigerante de dois litros, encha-a de água. Que forma tem essa água?
A forma da garrafa! Agora, despeje a água em uma bacia. Que forma ela passa a ter? A forma da bacia.
Os líquidos têm forma variável. E o volume. Quanta água havia na garrafa?
Dois litros. E na bacia? Os mesmos dois litros. Os líquidos têm volume constante.
Se nos sólidos a força de coesão é muito forte, nos líquidos ela é bem menor e, por isso, as partículas se apresentam mais afastadas do que nos sólidos e se movimentam com mais intensidade.

Estado gasoso
Observe o ar ao seu redor. É possível definir forma ou volume para ele? Não!
O ar é um exemplo de material no estado gasoso.
Nos gases, as forças de coesão são muito fracas, permitindo um grande afastamento das partículas, que são muito móveis e não mantêm uma forma ou um volume constantes.
Essa capacidade de ocupar espaços, característica dos gases, pode ser percebida quando há um vazamento de gás no fogão.
O gás se espalha pelo ambiente e podemos saber onde ele está por causa do odor característico.
O fato de ter um forte cheiro nos alerta para o perigo e mostra como um gás pode se expandir: escapando na cozinha, espalha-se pela casa e pode provocar uma explosão de consequências trágicas.
Em caso de vazamento de gás, devemos abrir as janelas e portas, permitindo que ele se expanda para fora de casa.
Atenção! Nunca acenda fósforos ou luz elétrica em um local com forte cheiro de gás, pois uma fagulha pode desencadear uma explosão.
(Observação: O GLP – gás liquefeito de petróleo ou gás de cozinha – é inodoro, mas recebe uma mistura contendo compostos que lhe dão o cheiro característico.)
Agora que você já sabe as características dos corpos em cada um dos três estados físicos, fica mais fácil entender a maneira pela qual muitos deles podem passar de um estado a outro.
Mudanças de estado da matéria
Nós vimos que a grande diferença entre os três estados físicos é o afastamento entre as partículas.
E isso está relacionado à intensidade de uma força: a força de coesão ou de atração. Se pudermos juntar moléculas muito distantes ou afastar aquelas que estão próximas, estaremos promovendo mudanças de estado.
E como poderíamos separar ou aproximar partículas constituintes da matéria?
Que tal apertando? Ou afrouxando o aperto?
Pois é, um dos fatores capazes de produzir mudanças de estado é a pressão. Grandes pressões aproximam partículas, redução de pressão permite que elas se afastem.
Outro fator capaz de promover mudanças de estado é a temperatura.
Quando aquecemos um corpo, estamos fornecendo energia térmica para suas partículas. Elas passam a ter um movimento mais intenso, chocam-se mais e afastam-se.
Então, pelo aumento de temperatura, é possível promover as mudanças de estado que levam a um afastamento das partículas.
O inverso acontece quando um corpo perde calor: sua temperatura diminui, as partículas se movimentam menos e se aproximam.
Se você prestou atenção, percebeu que as ações da pressão e da temperatura são inversas, ou seja, as mudanças que ocorrem pelo aumento da temperatura também podem ocorrer pela diminuição da pressão e aquelas que se dão pela diminuição de temperatura podem acontecer pelo aumento da pressão.
Atenção: para que haja a mudança de estado, não é necessário variarem os dois fatores, geralmente o fator variável é a temperatura.
Veja no esquema abaixo as mudanças de estado e o nome que damos a elas.
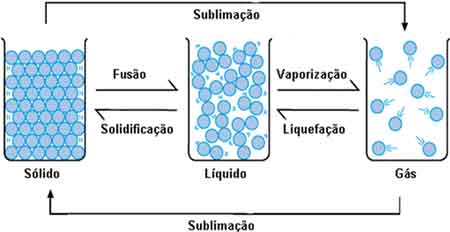
Cada substância possui uma temperatura na qual as mudanças de estado costumam ocorrer (essa temperatura depende da pressão).
A ela damos o nome de ponto de fusão, ponto de ebulição, ponto de condensação, ponto de solidificação ou ponto de sublimação, dependendo do fenômeno que estiver ocorrendo.
As diferentes temperaturas de mudança de estado são constantes físicas e propriedades específicas das substâncias.
Veja alguns exemplos: cada uma das substâncias ao lado passa de sólida à líquida (fusão) sempre a uma mesma temperatura, que é seu ponto de fusão. Os valores citados se referem ao
ponto de fusão à pressão ao nível do mar (de uma atmosfera): se a pressão variar, o valor já não será o mesmo.
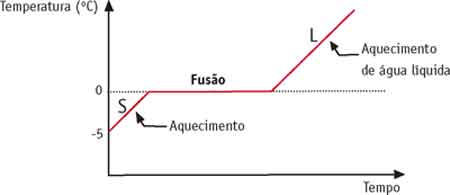
Podemos representar esse fenômeno por meio de um gráfico. Observe a curva de aquecimento da água.
Vimos pontos de fusão (passagem de sólido a líquido) de diversas substâncias. Os pontos de solidificação das mesmas substâncias (passagem de líquido a sólido) têm
valores iguais aos da fusão. A água (estado líquido) passa a gelo (estado sólido) quando sua temperatura chega a 0oC e se mantém nesse valor até que toda a massa líquida tenha se solidificado.
Tudo que estudamos sobre a fusão e a solidificação pode ser aplicado à vaporização (passagem de líquido a gasoso) e à condensação (passagem de gasoso a líquido).
A tabela ao lado mostra alguns pontos de ebulição e, por extensão, de condensação. Não esqueça que esses valores
sempre se referem às condições de pressão ambientais ao nível do mar (uma atmosfera). Obs: quanto maior a pressão atmosférica maior a temperatura de ebulição.
Podemos representar esse fenômeno por meio de um gráfico.
Observe a curva de aquecimento da água.
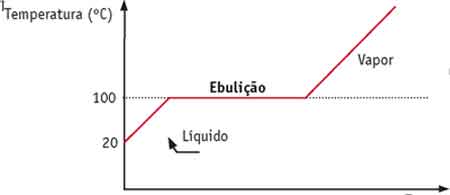
A temperatura em que ocorre a mudança de estado, além de ser constante, mantém-se inalterada durante o processo.
Vamos usar a água como exemplo: um bloco de gelo de temperatura -5°C é retirado do congelador e deixado no ambiente, cuja temperatura é de 20°C.
O gelo começa a esquentar, sua temperatura vai subindo gradualmente. Quando chega a 0°C, ele começa a derreter. Enquanto estiver derretendo, o gelo manterá temperatura de 0°C, que é o ponto de fusão da água.
Talvez você esteja estranhando o fato de que no parágrafo anterior falamos em vaporização e depois em ebulição.
Antes que haja confusão, vamos deixar bem claro que vaporização é a mudança de estado em que um líquido passa a vapor ou gás, porém essa mudança pode acontecer de diversas formas, recebendo nomes especiais.
Quando acontece lentamente, à temperatura ambiente, como roupa secando no varal, a água passa à forma de vapor sem a formação de bolhas.
Nesse caso, é vaporização do tipo evaporação. Ainda usando a água como exemplo, ela pode passar a vapor rapidamente e com formação de bolhas, como quando é posta para ferver. Nesse caso, dizemos que a vaporização é do tipo ebulição.
Exercício resolvido: estados físicos da matéria
- Observe a tabela com o ponto de fusão de alguns elementos químicos.
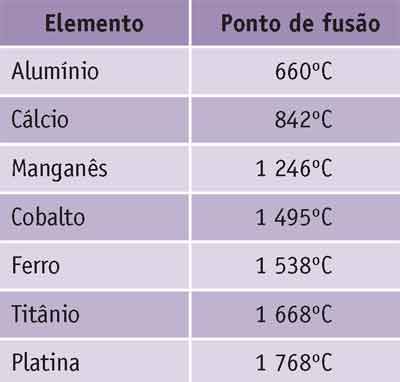
Imagine que amostras de cada um desses metais fosse colocada em um forno com temperatura interna de 1 480°C. Qual das amostras ainda estaria no estado sólido quando fosse retirada dali?
Solução:
As amostras de cobalto, ferro, titânio e platina, pois todos eles têm ponto de fusão acima dos 1 480°C. O cobalto só se transformaria em líquido a 1 495°C; o ferro, a
1 538°C; o titânio, a 1 668°C; e a platina, a 1 768°C.
- Ao lado das situações comuns em seu cotidiano, escreva a mudança de estado que está ocorrendo.
■ A calçada secou após a chuva._
■ O gelo de seu refrigerante derreteu._
■ A garrafa de álcool ficou aberta e “secou”._
■ O refrigerante guardado no congelador congelou._
■ Esqueci a chaleira no fogo e a água que estava nela “secou”._
- O ciclo da água só é possível porque a água das chuvas percorre um longo caminho e finalmente retorna à atmosfera formando as nuvens. Quais as mudanças de estado sofridas pela água em seu ciclo? Explique.
- Em uma panela de pressão, os alimentos são preparados mais rapidamente do que em uma panela aberta. Como se explica tal fato? Uma dica: lembre-se de que dentro da panela a pressão é muito maior do que fora.
- Em shows é muito usado o gelo-seco, que é dióxido de carbono (CO2) no estado sólido. O ponto de solidificação do CO2é de -78,5°C. Quando colocado em água, o gelo-seco sublima-se, produzindo a “fumaça” usada nos espetáculos. Pesquise o que é sublimação e então responda o que é essa fumaça.
- Uma pessoa está cozinhando arroz em uma panela aberta e com o fogo baixo. Quando a água começa a ferver, ela resolve “acelerar” o cozimento e aumenta a chama ao máximo. Dessa maneira, conseguirá cozinhar o arroz mais depressa? Justifique.
Atividade experimental
Objetivo: Demonstração de uma filtração.
Material:
■ funil de vidro;
■ bastão de vidro;
■ papel de filtro qualitativo;
■ suporte;
■ pinça;
■ copo de béquer;
■ hidróxido de cálcio (cal extinta).
Procedimento:
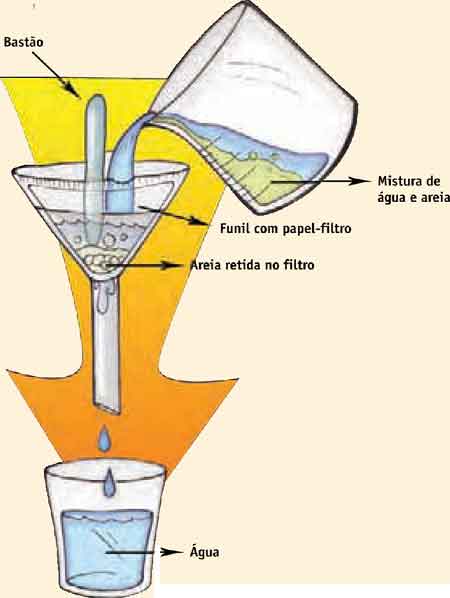
Em um copo de béquer, colocar água e uma quantidade razoável de hidróxido de cálcio. Misturar e levar ao sistema suporte-filtro. Derramar a mistura heterogênea sobre o filtro com papel, direcionando o fluxo com o bastão de vidro. Aguardar o término da filtração e discutir com os alunos os resultados.
Observe a figura que representa o sistema de filtração:
Referências Bibliográficas